Autores – Gabriel Castilla Cañamero, Iván Martín-Méndez y Enrique Merino Martínez
Allí donde se manifiesta el mineral, la eternidad habla.
Michel Onfray. Estética del Polo Norte, 2015
A finales de febrero de 1896, el químico Henri Becquerel realizó un experimento curioso: colocó un paquete de sales de uranio junto a una placa fotográfica envuelta en papel negro y las guardó en el cajón de un escritorio. Días después, descubrió que las sales habían dejado unas manchas borrosas en la placa, como si algún tipo de rayo invisible capaz de atravesar los objetos hubiera dejado su huella (Figura 1). Intrigado por la naturaleza de este fenómeno, compartió el hallazgo con una investigadora de doctorado de origen polaco llamada Marie. En junio de 1903, Marie defendió su tesis doctoral titulada: Investigaciones sobre sustancias radiactivas, en la que demostraba que ciertos elementos, como el uranio, emiten energía de forma constante. Pocos meses después, Bequerel, Marie y su esposo Pierre Curie fueron galardonados con el Premio Nobel de Física por el descubrimiento de la radiactividad espontánea.

Figura 1. Plancha fotográfica de Henri Becquerel que fue expuesta a la radiación emitida por el uranio a finales de febrero de 1896. Este tipo de descubrimiento, totalmente casual pero de gran valor científico, se conoce como serendipia. En la imagen se aprecia la forma de una cruz de Malta que se encontraba guardada en el mismo cajón, entre la placa fotográfica y las sales de uranio. Fuente: Archivo Becquerel/Wikipedia Commons.
Apenas un año después, el físico Ernest Rutherford descubrió que los elementos químicos radiactivos se transforman en otros a lo largo del tiempo: el uranio (U), por ejemplo, se convierte lentamente en plomo (Pb). Esta transformación, denominada desintegración radiactiva, ocurre a velocidad constante y predecible (Figura 2). Rutherford sugirió al químico Bertram Boltwood una idea revolucionaria: la posibilidad de usar esta descomposición radiactiva para calcular la edad de una roca midiendo la proporción de los dos elementos presentes en ella. En 1907, Boltwood aplicó por primera vez este principio al binomio uranio-plomo en una serie de muestras de rocas y estimó que algunas de ellas podían tener hasta 2.200 millones de años de antigüedad. Así, en apenas una década, el estudio de la radiactividad dio origen al método de datación radiométrica y permitió cuantificar el tiempo geológico con precisión numérica.

Figura 2. Como se puede apreciar en la gráfica, la descomposición radiactiva es un proceso de tipo exponencial. En rojo tenemos la cantidad de elemento radiactivo presente en cada momento: primero disminuye muy rápido y luego más lentamente hasta llegar a cero. La vida media o período de semidesintegración es el tiempo que tarda un conjunto de átomos en quedar reducido a la mitad. Como podemos ver en la Tabla I, algunas desintegraciones son tan lentas que tienen vidas medias más largas que la vida del Universo. Adaptado de Anguita (1988).
La idea era prometedora, pero…
Pese a la promesa del método, los pioneros de la datación tuvieron que salvar tres grandes obstáculos:
1º. Falta de conocimiento sobre los isótopos: Rutherford y Boltwood desconocían la existencia de los neutrones en el núcleo de los átomos y por tanto el papel que juegan los isótopos en el proceso de desintegración.
2º. Dudas sobre lo que se databa exactamente: Existían serias dudas sobre si las dataciones obtenidas señalaban la edad de cristalización de los minerales, la edad de formación de las rocas, o simplemente la antigüedad de los elementos químicos que los forman. Tampoco estaba claro si se podía aplicar este método a rocas ígneas, metamórficas y sedimentarias por igual.
3º. Limitaciones técnicas: A los problemas de índole teórico, había que sumarle las dificultades técnicas; aislar y medir con suficiente precisión pequeñas cantidades de elementos en las rocas requería de instrumentos que aún no existían.
El papel de los isótopos.
Los elementos químicos están formados por átomos, los cuales, a su vez, están compuestos por electrones, protones y neutrones. Sin embargo, estos últimos no fueron descubiertos hasta 1932, cuando el físico James Chadwick los identificó. En los elementos químicos, el número de protones define su identidad; el número de neutrones, en cambio, puede variar. Hoy sabemos que muchos elementos químicos poseen isótopos, es decir: variantes de un mismo elemento que difieren en el número de neutrones presentes en el núcleo. En la naturaleza existen dos tipos de isótopos: los estables y los inestables (o radiactivos), y son estos últimos los que se pueden emplear en las dataciones.
En el caso del uranio, la Tabla Periódica de los Elementos indica que su número atómico es 92, lo que significa que en estado natural posee 92 electrones y 92 protones, además de un número variable de neutrones que define sus tres isótopos:
1.- El Uranio-234 (234U) con 92 protones y 142 neutrones.
2.- El Uranio-235 (235U), que tiene 92 protones y 143 neutrones.
3.- El Uranio-238 (238U), que posee 92 protones y 146 neutrones.
En términos prácticos, esto quiere decir que en 1 gramo de uranio están presentes los tres isótopos en distinta proporción. El más abundante en la naturaleza es el 238U que representa el 99,2 % de la masa de cualquier muestra que tomemos al azar, y le siguen el 235U con un 0,7 % y el 234U con menos de un 0,1 %.
Los tres isótopos de Uranio (U) son radiactivos, pero los dos primeros se usan comúnmente en geocronología porque se desintegran a isótopos estables de plomo (Pb): el 238U se transmuta por descomposición radiactiva en 206Pb, un proceso cuya vida media es de 4.470 millones de años (Figura 3), mientras que el 235U se transforma en 207Pb en un tiempo medio de 700 millones de años.

Figura 3. Secuencia de trasmutaciones que llevan del uranio-238 al plomo-210. El polonio-214 (que debe su nombre a la tierra natal de Marie Curie) es el isótopo más inestable de la serie, con una vida media de menos de un segundo. Adaptado de Anguita (1988).
El triunfo de la datación mediante uranio-plomo
El binomio uranio-plomo es ideal para datar rocas antiguas debido a su larga vida media. De hecho fue empleado por el geólogo norteamericano Clair Patterson para alcanzar uno de los hitos más importantes en geología: establecer por primera vez la edad absoluta de la Tierra.
¿Cómo lo hizo?
A su director de tesis, el geoquímico Harrison Brown, se le ocurrió la idea de que, en lugar de centrarse en medir la cantidad de uranio presente en una roca antigua, sería más sencillo detectar la presencia de isótopos de plomo acumulado como producto de su desintegración. Esta técnica, conocida hoy como método de acumulación o datación plomo-plomo, permitió abordar el problema desde una nueva perspectiva, evitando errores debido a la pérdida o ganancia de uranio. Pero, ¿dónde encontrar muestras de roca a priori tan antiguas como la propia Tierra? Patterson asumió acertadamente que los planetas se formaron como resultado de un proceso de acreción de partículas a partir de una nebulosa de gas y de polvo, y que los meteoritos que en la actualidad impactan contra la Tierra son los escombros supervivientes de aquel proceso. O sea: se propuso datar estos “ladrillos sobrantes” para estimar cuándo comenzó a formarse la edad del “edificio planetario”.
Aislar una suficiente cantidad de minerales presentes en meteoritos (rocas de origen extraterrestre y, por tanto, ya de por sí escasas), que contuvieran algo de uranio, pero sobre todo plomo, fue una tarea ardua. Además, debía asegurarse que estas muestras no estuvieran contaminadas por agentes externos, como el plomo procedente de la combustión de gasolina. Este desafío requirió siete años de meticuloso trabajo y llevó al diseño y a la creación del primer laboratorio de geoquímica esterilizado del mundo (hoy en día denominados “Salas Blancas” – Figura 4-).

Figura 4. Clair Patterson limpiando su laboratorio para evitar la contaminación. Fuente: Archivos y Colecciones Especiales del Instituto Tecnológico de California (Caltech Archives CCP145.5-7).
Finalmente, en 1953, las muestras fueron analizadas con la ayuda de un (entonces novedoso) espectrómetro de masas, un instrumento que permite separar con mucha precisión los elementos que constituyen un mineral. ¿El resultado? Patterson calculó la edad de la Tierra en 4.550 millones de años, con un margen de error de más o menos unos 70 millones de años, (¡menor del 2% a pesar de los medios disponibles en ese momento!). En líneas generales este valor continúa siendo válido en la actualidad.
El circón: una trampa para el uranio
A medida que avanzaba el conocimiento sobre la vida media de las transmutaciones radiactivas de los isótopos y mejoraba la precisión de la espectrometría de masas, surgieron nuevos métodos de datación radiométrica, útiles para datar diferentes tipos de rocas y minerales (Tabla I). A pesar de ello, el método uranio-plomo sigue siendo el más fiable para calcular la edad de rocas muy antiguas, y la principal razón es que hoy disponemos de una técnica mucho más depurada gracias al papel que desempeña un mineral con propiedades extraordinarias: el circón.

El circón (silicato de zirconio: ZrSiO4) es un mineral accesorio de pequeño tamaño que cristaliza a partir de magmas procedentes del manto superior o de la base de la corteza terrestre, por lo que es un mineral muy común en rocas ígneas, como el granito (Figura 5). Durante su formación tiende a incorporar diversos elementos que reemplazan parcialmente el circonio (Zr) en su estructura cristalina, tales como uranio, torio, titanio y elementos de las tierras raras; pero rechaza fuertemente el plomo durante su crecimiento. Una vez cristalizado, retiene estos elementos, principalmente el uranio, del que puede llegar a tener entre 100 y 1000 ppm (partes por millón). Y puesto que rechazó el plomo durante la cristalización, cualquier plomo que aparezca posteriormente dentro de su estructura se debe exclusivamente a la desintegración radiactiva. Es decir, se puede asumir que todo el 206Pb y 207Pb presentes cuando se analiza una muestra tiene su origen en la descomposición radiogénica del uranio.

Figura 5. Circones centimétricos (flechas) cristalizados en un granito procedente de Paquistán (izquierda) y aspecto de un ejemplar de tamaño submilimétrico visto con una lupa (derecha). Fuente: colección Gabriel Castilla y Wikipedia Commons.
Además, el circón es durísimo y resiste altas temperaturas, presiones y procesos geológicos como el metamorfismo o la erosión, lo que le permite conservar su firma isotópica incluso después de miles de millones de años. Puede crecer (recristalizar) en rocas metamórficas en condiciones de alta presión y hasta 900 ºC de temperatura, permitiendo datar el evento (o los eventos) en el que volvió a integrar uranio en su estructura (que posteriormente volverá a transformarse en plomo). Igualmente, su gran dureza le permite sobrevivir intacto a ciclos de erosión, transporte y sedimentación, manteniéndose “químicamente estable” en forma de grano detrítico en el interior de rocas sedimentarias, y permitiendo datar la edad máxima de deposición de esas rocas.

Receta para analizar un circón
1º. Se realiza un estudio de campo y se recolectan las muestras de roca de interés.
2º. Las rocas son molidas y tamizadas. El polvo grueso de roca obtenido es lavado y separado por gravedad para concentrar los minerales más pesados.
3º. Los concentrados de minerales pesados se seleccionan y extraen con un separador magnético.
4º. La purificación final se logra separando a mano cada circón. Como no miden más de 1mm esta tarea se realiza con ayuda de una lupa binocular y pinzas finas.
5º. Los circones se pegan en cinta de doble cara y se montan en moldes, que son rellenados con una resina.
6º Cuando la resina ya está consolidada, se pule para que la parte central de los minerales quede expuesta y se pueda analizar.
En la actualidad los circones se analizan química e isotópicamente mediante varias técnicas derivadas de la espectrometría de masas, principalmente dos:
(1) La microsonda iónica de alta resolución (Super High-Resolution Ion Micro-Probe, también conocida como SHRIMP).
(2) El espectrómetro de masas de plasma acoplado inductivamente y ablación láser (LA-ICP-MS, siglas de Laser Ablation Inductively Coupled Plasma Mass Spectrometer).
Estas técnicas permiten estudiar con gran precisión partes muy concretas de un cristal, vaporizan los átomos de uranio y plomo que surgen de un punto seleccionado (Figura 7). Los datos que se obtienen se procesan y se corrigen para ser usados en los cálculos de relaciones isotópicas de U-Pb (y Th) y estimación final de edades.
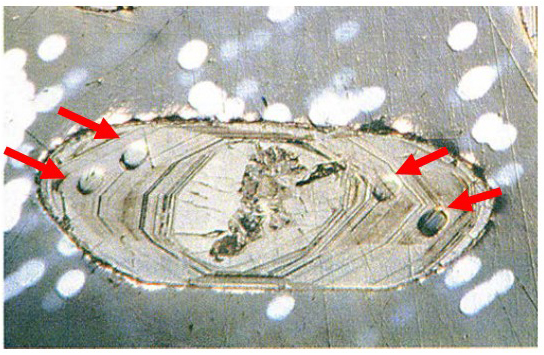
Figura 7. Circón procedente del gneis de Acasta (Canadá). Los pequeños círculos que se observan fueron producidos por haces de iones que vaporizaron partes del cristal para establecer la relación de uranio y plomo en esos puntos concretos. Ha sido datado en unos 4.000 millones de años. Adaptado de York (1993).
Una gráfica para datarlos a todos
Cuando se forma un circón (cristaliza por debajo de los 900 º C), el sistema uranio-plomo se reinicia. A medida que pasa el tiempo los isótopos de plomo creados por la descomposición radiactiva del uranio quedan atrapados y se concentran. Si nada lo perturba, datarlo es muy sencillo: solo habrá que situar las concentraciones de plomo respecto al uranio inicial sobre una gráfica, la llamada curva de concordia, que se construye relacionando las cantidades de isótopos de plomo que se forman a partir de los dos principales isótopos de uranio (Figura 8a).

Figura 8a. Curva de concordia para el sistema uranio-plomo. El hecho de conocer con precisión las vidas medias de los dos principales isótopos del uranio nos permite construir una gráfica con proporciones plomo/uranio muy concretas para los 4.550 millones de años de historia de la Tierra. En una roca de 704 millones de años, el 235U está en su vida media por lo que habrá una relación Pb/U = 1. En una roca de 1.408 millones de años solo quedará un átomo de 235U por cada tres átomos de 207Pb, por lo que la relación Pb/U = 3, y así sucesivamente. En el caso del 238U la descomposición es más lenta, por eso en ese eje de la gráfica las relaciones adoptan valores menores que 1. Los puntos negros sobre la curva señalan las edades para esas proporciones en giga años (Ga), es decir miles de millones de años (1Ga = 1000.000.000 años).
Es muy raro que a lo largo de los miles de millones de años de la historia de la Tierra un circón no se vea alterado por cambios de presión y temperatura en su entorno. Cuando esto sucede, pueden escapar isótopos de plomo, por lo que las dataciones ya no caerán exactamente sobre la curva de concordia. Es decir, se abre y distorsiona el sistema isotópico. Es aquí cuando toma sentido datar muchos circones con el fin de establecer diversos niveles de pérdida de plomo y con ellos establecer una recta de discordia, recta que cortará la curva de concordia en dos puntos, lo que proporcionará información sobre la edad del circón y sobre el supuesto momento en que se produjo el episodio de metamorfismo que alteró la química del mineral (Figura 8b).
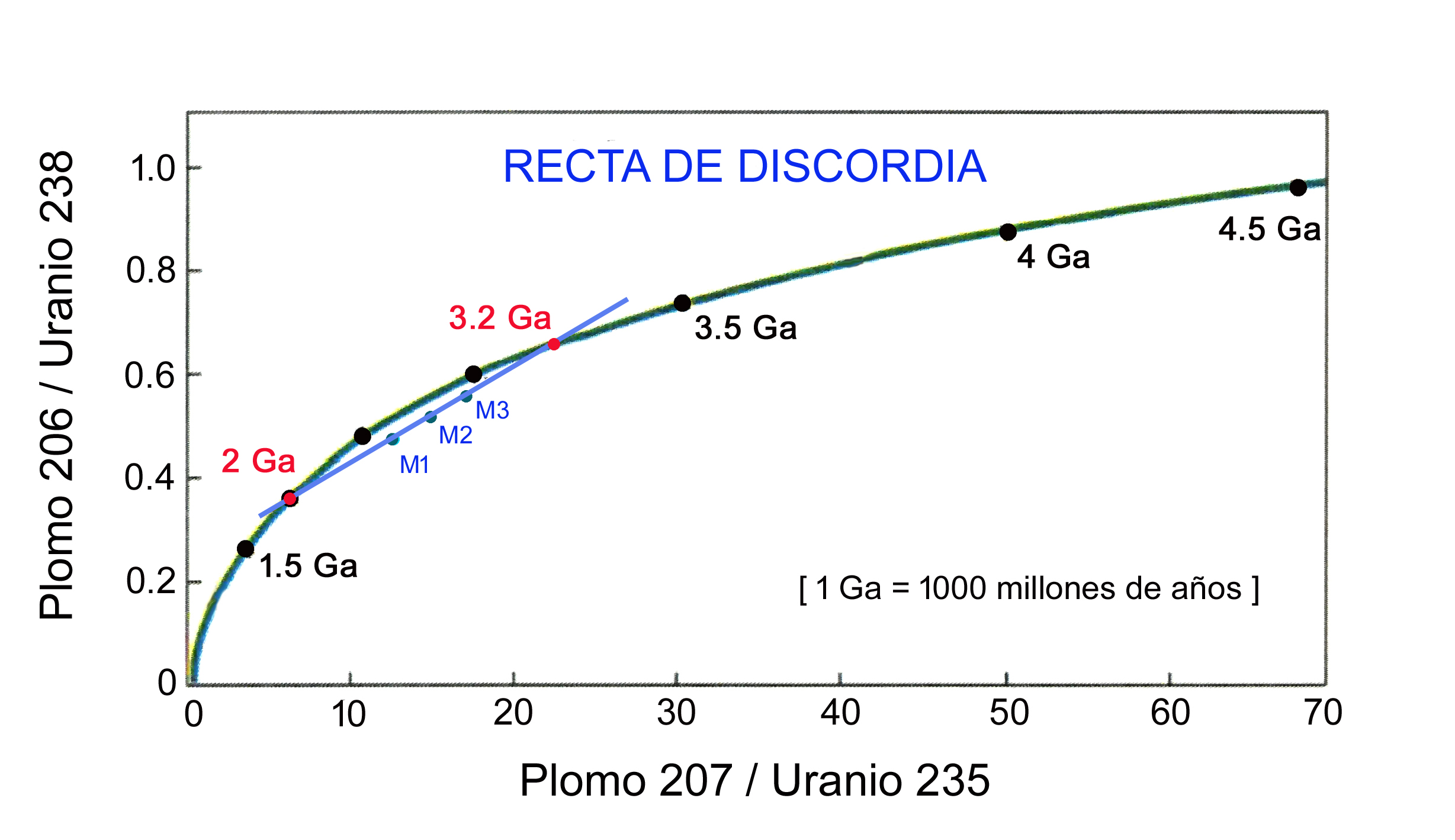
Figura 8b. Diagrama de concordia para tres muestras de circones (M1, M2 y M3) de una roca antigua que ha experimentado una alteración por metamorfismo (cambio de presión y temperatura pero sin llegar a fundir). La recta de discordia intersecta la curva “por arriba” en 3.2 Ga, revelando la edad de la roca que contiene las tres muestras, y “por abajo” en 2 Ga, señalando el momento en que se produjo el episodio de alteración metamórfica que desencadenó la pérdida de plomo. Adaptado de York (1993) y elaboración propia.

Nuevos avances en datación U-Pb
El circón sigue siendo el mineral insignia para la datación geocronológica, por su resistencia y fiabilidad. Sin embargo, los nuevos avances en la precisión de los métodos instrumentales y analíticos han permitido que, además del circón, actualmente se pueden datar otros minerales mediante el método uranio-plomo. Algunos de los más utilizados son:
Monacita (CePO4): rica en uranio y torio, y común en rocas metamórficas y graníticas. Es menos resistente al metamorfismo que el circón, pero muy útil en geología regional para datar procesos metamórficos.
Xenotima (YPO4): similar a la monacita pero con itrio en lugar de cerio. También incorpora uranio y se encuentra en rocas ígneas y metamórficas.
Titanita (o esfena, CaTiSiO5): contiene uranio en cantidades moderadas, siendo más susceptible a pérdidas de Pb que el circón. Se emplea en rocas ígneas y metamórficas, siendo importantes en rocas pobres en circón.
Baddeleyita (ZrO2): se encuentra en basaltos y gabros antiguos, y rocas mantélicas donde el circón es raro o ausente.
Bibliografía consultada.
Allégre, C.J.; Manhès, G. y Göpel, C. (1995). The age of the Earth. Geochimica et Cosmochimica Acta, Vol. 59 (8), pp.1445-1456.
Anguita, F. (1988). Origen e Historia de la Tierra. Editorial Rueda.
Bellucci, J.J. et al. (2019). Terrestrial-like zircon in a clast from an Apollo 14 breccia. Earth and Planetary Science Letters 510, pp. 173-185.
Bryson, B. (2003). Una breve historia de casi todo. Edición especial ilustrada. RBA Editores.
Casado, M. J. (2006). Las damas del laboratorio. Editorial Debate.
Greshko, M. (2019). La posible roca más antigua de la Tierra se recogió en la Luna. National Geographic. Versión on-line.
Guo, J-L. et al. (2000). Significant Zr isotope variations in single zircon grains recording magma evolution history. Proceedings of the National Academy of Sciences, Vol. 117 (35), pp. 21125-21131.
Harley, L. y Kelly, N.M. (2007). Zircon- Tyny but Timely. Elements, 3 (1).
Mennekem, M. et al. (2007). Hadean diamonds in zircon from Jack Hills, Western Australia. Nature 448 (7156), pp. 917-920.
Naipauer, M. (2021). Circones, los relojes de la Tierra. Ciencia Hoy, Vol. 30, n. 176, pp. 51-57.
Patterson, C. (1956). Age of meteorites and the Earth. Geochimica et Cosmochimica Acta, Vol. 10, pp.230-237.
Valley. J. W. et al. (2014). Hadean age for a post-magma-ocean zircon confirmed by atom-probe tomography. Nature Geoscience 7, pp. 219-223.
Wilde, S.A.; Valley, J.W.; Peck, W.H. y Graham, C.M. (2001). Evidence from detrital zircons for the existence of continental crust and oceans on the Earth 4.4 Gyr ago. Nature, 409 (6817), pp.175-178.
York, D. (1993). Protohistoria de la Tierra. Investigación y Ciencia, 198 (marzo), pp.40-47.
