Texto: Fina Muñoz Sanz y Ana Isabel Casado Gómez
Ilustradora: Ana Isabel Casado Gómez
El agua es un líquido vital. Constituye aproximadamente el 60 % del cuerpo humano, cubre en torno al 71 % de la superficie de nuestro planeta y es imprescindible para que tengan lugar las reacciones metabólicas en el interior de las células. Su presencia es, por tanto, un criterio fundamental a la hora de valorar si en un planeta existe o ha existido vida. Quizá por ello solemos decir que “donde hay agua, hay vida”, aunque sería más preciso afirmar que “donde hay vida, hay agua”.
Como ya explicamos en el post dedicado a la formación de los océanos, existen varias hipótesis sobre el origen del agua en la Tierra. Algunas proponen un aporte externo mediante cometas o meteoritos, mientras que otras plantean que los impactos a alta velocidad habrían favorecido la combinación de átomos de oxígeno e hidrógeno durante las primeras etapas de formación del planeta.
¿POR QUÉ ES UN LÍQUIDO ESPECIAL?
Las propiedades del agua como sustancia son especialmente singulares. Analizar algunas de ellas, como su densidad anómala (fig. 1), permite comprender fenómenos tan llamativos como la formación de los icebergs. A diferencia de la mayoría de las sustancias, el agua en estado líquido es más densa que en estado sólido, alcanzando su densidad máxima a 4 °C.
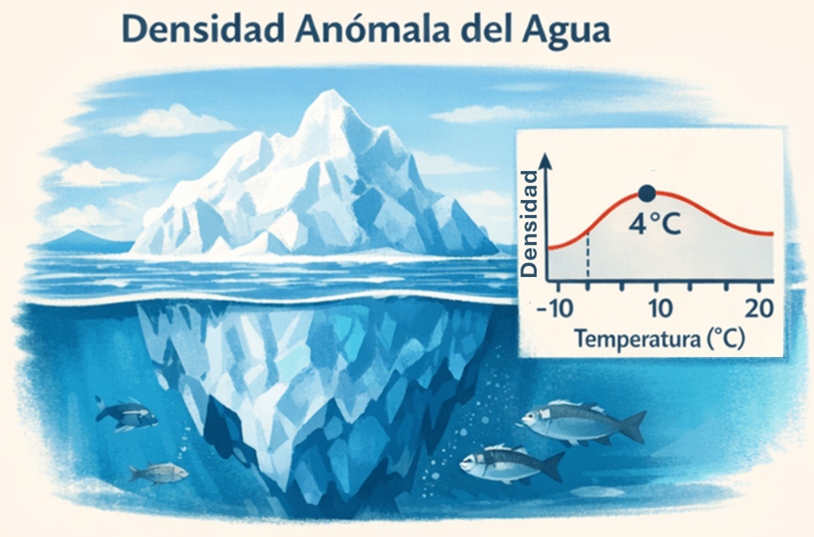
El agua alcanza su densidad máxima a 4 °C, de modo que el hielo (agua en estado sólido) es menos denso y flota sobre el agua líquida. Este comportamiento anómalo explica la formación de icebergs y permite que, bajo la capa de hielo superficial, el agua permanezca líquida, posibilitando la vida acuática en ambientes fríos.
Otra propiedad destacable es la elevada cohesión entre sus moléculas, lo que le aporta una alta tensión superficial (fig. 2). Los enlaces covalentes del agua, reforzados por los puentes de hidrógeno (fuerzas de Van der Waals), hacen que las moléculas se mantengan fuertemente unidas. Gracias a esta cohesión, algunos insectos, como los zapateros (Gerris lacustris), pueden desplazarse sobre la superficie del agua sin hundirse.
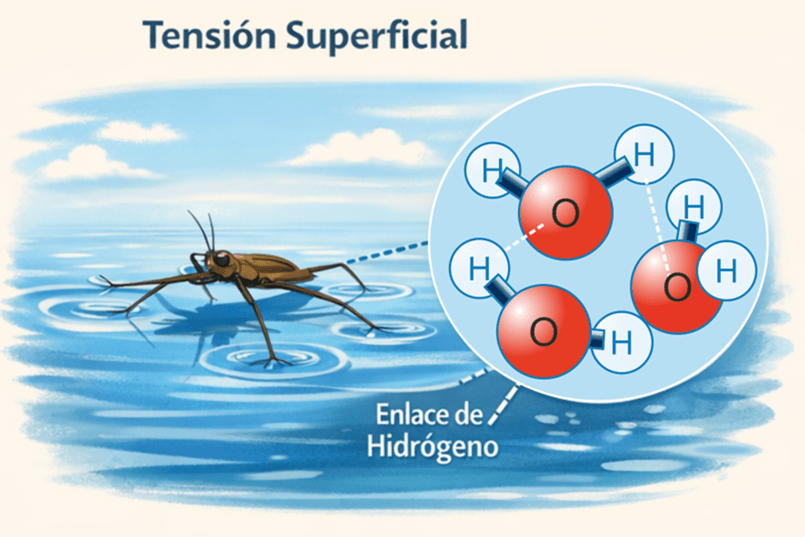
La fuerte cohesión entre las moléculas de agua, debida a los enlaces covalentes y reforzada por los puentes de hidrógeno, genera una elevada tensión superficial. Esta propiedad permite que pequeños organismos, como los insectos zapateros, puedan desplazarse sobre la superficie del agua sin hundirse.
Asimismo, el agua presenta una notable capacidad de adhesión a otras superficies. Este fenómeno que llamamos capilaridad (fig. 3), puede observarse, por ejemplo, en las paredes de un tubo de ensayo o en los vasos conductores de las plantas, por los que la savia bruta asciende desde las raíces hasta las hojas.
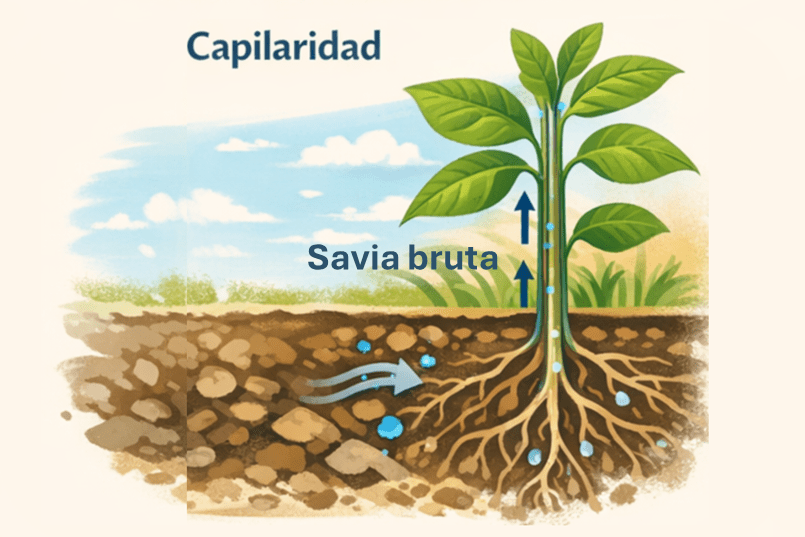
La combinación de las fuerzas de cohesión entre las moléculas de agua y de adhesión a las superficies sólidas permite el ascenso del agua por conductos estrechos. Este fenómeno, conocido como capilaridad, resulta esencial en las plantas, ya que posibilita el transporte de la savia bruta desde las raíces hasta las hojas.
Por último, y no menos importante, destaca su gran poder disolvente. Debido al carácter dipolar de la molécula de agua, la carga eléctrica se distribuye de manera desigual, con una región ligeramente positiva y otra negativa. Esta característica permite disolver compuestos iónicos y polares, lo que convierte al agua en un medio fundamental para el transporte de sustancias. Por ejemplo la sal común (NaCl) en agua, se disuelve liberando iones Na⁺ y Cl⁻ (fig. 4).
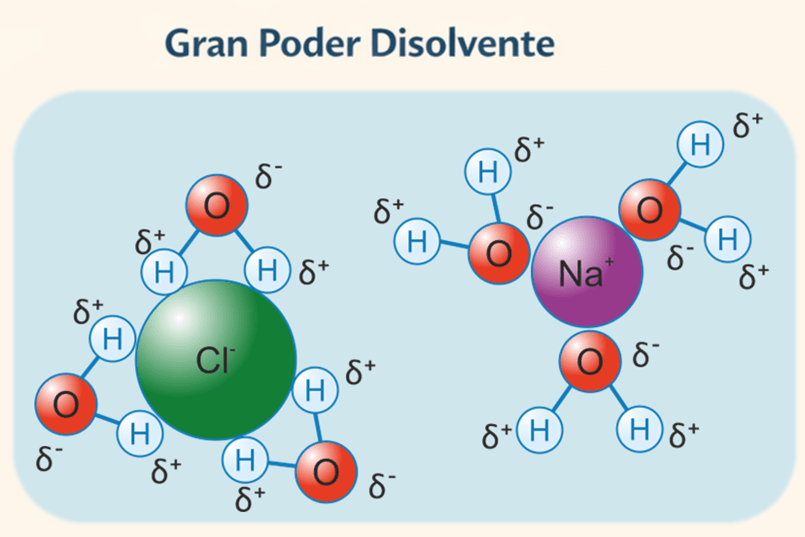
El carácter dipolar de la molécula de agua, con una distribución desigual de cargas eléctricas, permite la atracción y estabilización de iones con carga positiva y negativa. Esta propiedad facilita la disolución de compuestos iónicos, como el cloruro sódico, al rodear y separar los iones sodio (Na⁺) y cloruro (Cl⁻), haciendo posible su transporte en disolución.
¿Sabías que…
…un ion es un átomo o molécula que ha ganado electrones —adquiriendo carga negativa y denominándose anión— o que ha perdido electrones —adquiriendo carga positiva y llamándose catión (fig. 5)?
En el agua, las moléculas de H₂O pueden autoionizarse formando iones de hidrógeno (H⁺) y de hidroxilo (OH⁻). Estos iones generan fuerzas de atracción que favorecen la disolución de los compuestos.
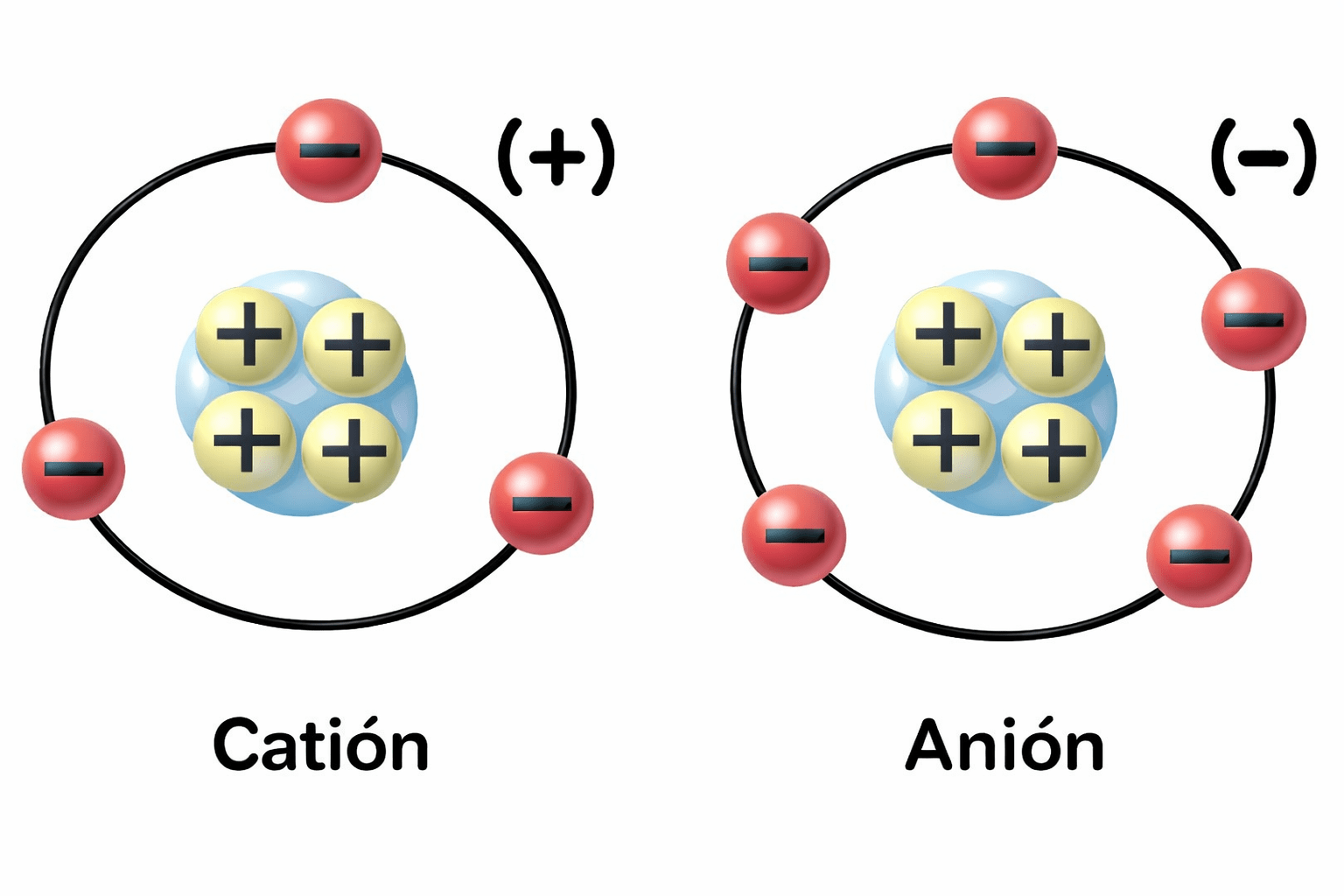
Un ion es un átomo o molécula que adquiere carga eléctrica al ganar o perder electrones. Cuando un átomo pierde uno o más electrones, queda con carga positiva y se denomina catión; cuando los gana, adquiere carga negativa y se denomina anión. Este proceso es fundamental para comprender la disolución de sales y la composición química de las aguas naturales.
EL RECORRIDO DE UNA GOTA DE AGUA
Tras la evaporación del agua de los océanos, el vapor se condensa y forma nubes que precipitan sobre la superficie terrestre. Parte de esta agua se infiltra en el subsuelo, empapando las rocas y dando lugar a los acuíferos. Un acuífero es una formación geológica capaz de almacenar y transmitir agua a través de sus poros y fracturas.
La infiltración del agua de lluvia hasta los acuíferos es un proceso lento que atraviesa los distintos horizontes del suelo. Aunque el agua no es completamente pura —puede contener partículas en suspensión, microorganismos o gases disueltos—, durante su recorrido subterráneo interactúa con los materiales que encuentra, modificando progresivamente su composición química. De este modo, cuando el ciclo natural del agua (fig. 6) se ve interrumpido por la captación humana mediante fuentes o pozos, el agua puede utilizarse, entre otros usos, como agua para consumo humano.
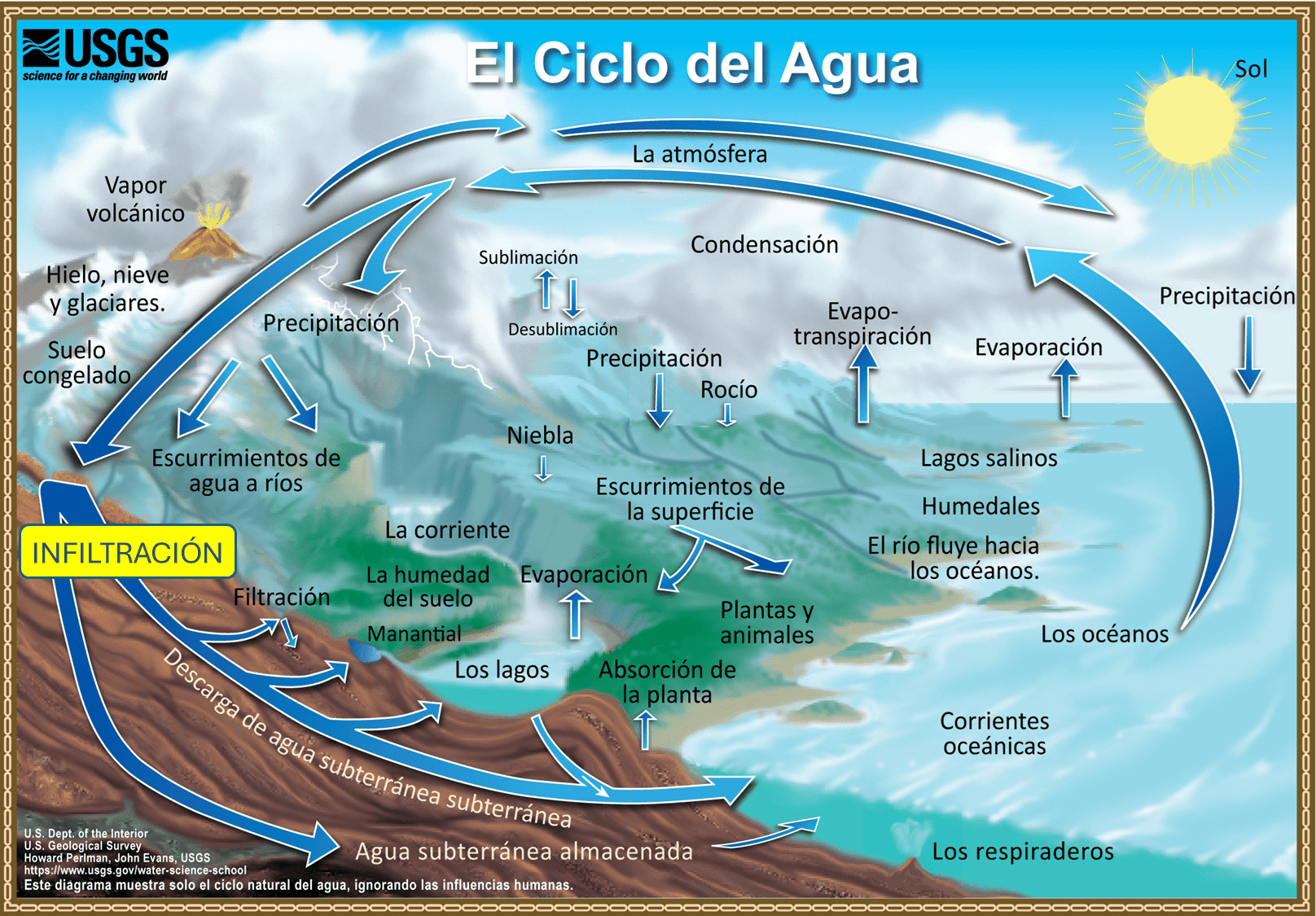
Esquema del ciclo hidrológico que muestra los principales procesos de circulación del agua entre la atmósfera, la superficie terrestre y el subsuelo, incluyendo evaporación, condensación, precipitación, escorrentía, infiltración y flujo subterráneo. Este ciclo continuo regula la distribución del agua en la Tierra y es esencial para el mantenimiento de los ecosistemas y de la vida.
Modificado de U.S. Geological Survey (USGS).
Cuando el agua subterránea aflora de forma natural en un manantial y cumple las condiciones adecuadas para el consumo humano, recibe la denominación de agua mineral natural. Aunque la fórmula química del agua es H2O, su elevado poder disolvente hace que el agua que bebemos contenga diversos elementos disueltos en forma iónica.
Estos iones permiten clasificar las aguas minerales según su composición química. Entre las más habituales se encuentran las aguas cálcicas, sódicas, magnésicas, bicarbonatadas, cloruradas o combinaciones iónicas varias.
¿QUÉ BEBEMOS CUANDO BEBEMOS AGUA?
Según la cantidad total de iones disueltos, las aguas minerales se clasifican en aguas de mineralización muy débil, débil, media o fuerte, en función del residuo seco (BOE n.º 16, de 19 de enero de 2011). Si el agua estuviera compuesta exclusivamente por H₂O, sería un líquido inodoro e insípido; sin embargo, el agua que consumimos presenta determinadas propiedades organolépticas. De este modo, la mineralización establece un vínculo directo entre la química del agua y su sabor u olor.
Las etiquetas de las botellas de agua mineral (fig. 7) proporcionan información detallada sobre el producto. Además de indicar la localización y denominación del manantial, las empresas embotelladoras están obligadas a realizar análisis periódicos de control de calidad, en los que se especifica la concentración de las sustancias disueltas y el laboratorio responsable del análisis.

Ejemplo de etiqueta de agua mineral en la que se detalla el residuo seco y la concentración de los principales iones disueltos, expresados en mg/L, junto con la fecha y el laboratorio responsable del análisis, así como la localización del manantial de origen. Esta información permite conocer el grado de mineralización del agua y relacionar su composición química con sus propiedades organolépticas.
El residuo seco es uno de los parámetros más relevantes y se refiere al peso del material obtenido tras evaporar un litro de agua, generalmente a unos 180 °C. Se expresa en mg/L y constituye un indicador directo del grado de mineralización, influyendo de forma notable en el sabor del agua (tabla 1).
| MINERALIZACIÓN DEL AGUA MINERAL | RESIDUO SECO (mg/L) |
| Muy débil | Hasta 50 |
| Débil | 50-500 |
| Media | 500-1500 |
| Fuerte | más de 1500 |
¿Sabías que…
…el oficio de catador o catadora consiste en evaluar la calidad sensorial de alimentos y bebidas?
Aunque es más conocido en productos como el vino —donde reciben el nombre de sumilleres—, también existen especialistas en queso, café, chocolate o yogur. De forma mucho menos habitual, existen catadores y catadoras de agua capaces de distinguir hasta un centenar de tipos diferentes.
Otro parámetro relacionado con el contenido mineral es la dureza del agua, definida como su capacidad para consumir jabón o producir incrustaciones. La dureza depende principalmente de la concentración de iones alcalinotérreos, especialmente calcio y magnesio, y está relacionada con la presencia de carbonatos disueltos. Es un parámetro utilizado en las instrucciones de las lavadoras, con diferencias en todo el territorio español (fig. 8) influenciadas en parte por la naturaleza geológica del terreno.

Las aguas de mineralización media o fuerte se denominan aguas duras, mientras que las de mineralización débil se conocen como aguas blandas. Estos conceptos son habituales en ámbitos como la fontanería, ya que la dureza del agua influye en la formación de cal en las tuberías y en la eficacia de los detergentes; un agua dura dificulta la acción del jabón, lo que obliga a aumentar la cantidad de detergente para lograr una limpieza adecuada (fig. 9).
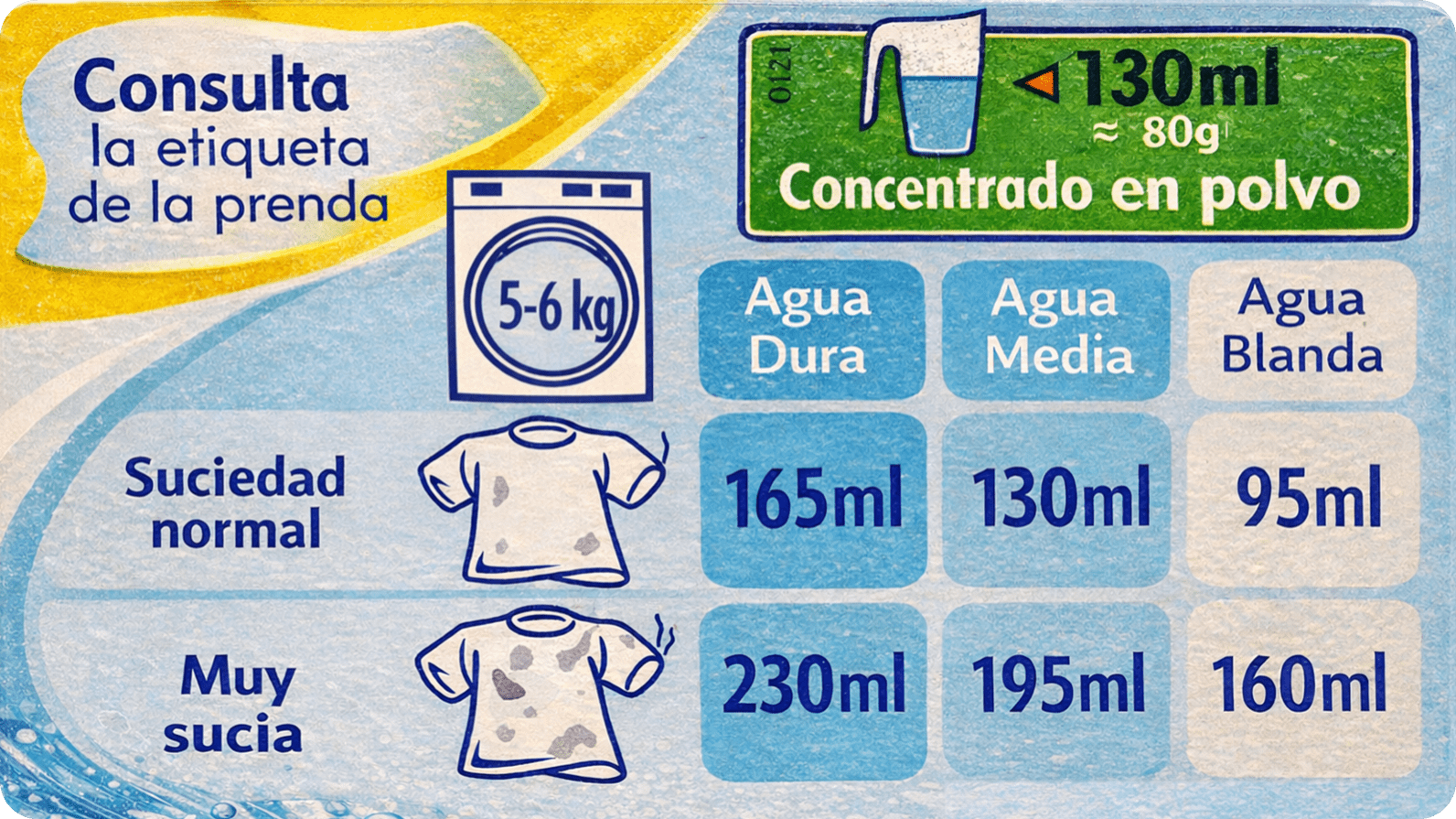
Ejemplo de recomendaciones de dosificación de detergente en función de la dureza del agua y del grado de suciedad de la ropa. Las aguas duras, con mayor contenido en calcio y magnesio, requieren una mayor cantidad de detergente para lograr una limpieza eficaz, mientras que las aguas blandas permiten reducir la dosis necesaria.
¿PERO DE DÓNDE VIENEN ESOS MINERALES DISUELTOS?
Antes de ser embotellada, el agua de un manantial ha circulado por formaciones rocosas denominadas acuíferos, disolviendo minerales a lo largo de su recorrido, los componentes de la roca. No obstante, no existe una relación directa y sencilla entre el tipo de roca y la composición química del agua, ya que esta interacción depende además de numerosos factores, entre ellos:
- las condiciones climáticas
- el grado de alteración de la roca
- el tiempo de contacto agua-roca
- la permeabilidad del material
- la longitud del recorrido subterráneo
- la alterabilidad de los minerales
En términos generales, el paso del agua por las rocas deja una “huella” en forma de iones disueltos. Aunque es difícil establecer valores exactos, puede enunciarse una relación cualitativa: rocas duras suelen dar lugar a aguas blandas, mientras que rocas más alterables generan aguas más duras. Cuanto más fácilmente se altera una roca, mayor es la cantidad de iones que puede ceder al agua (fig. 10).
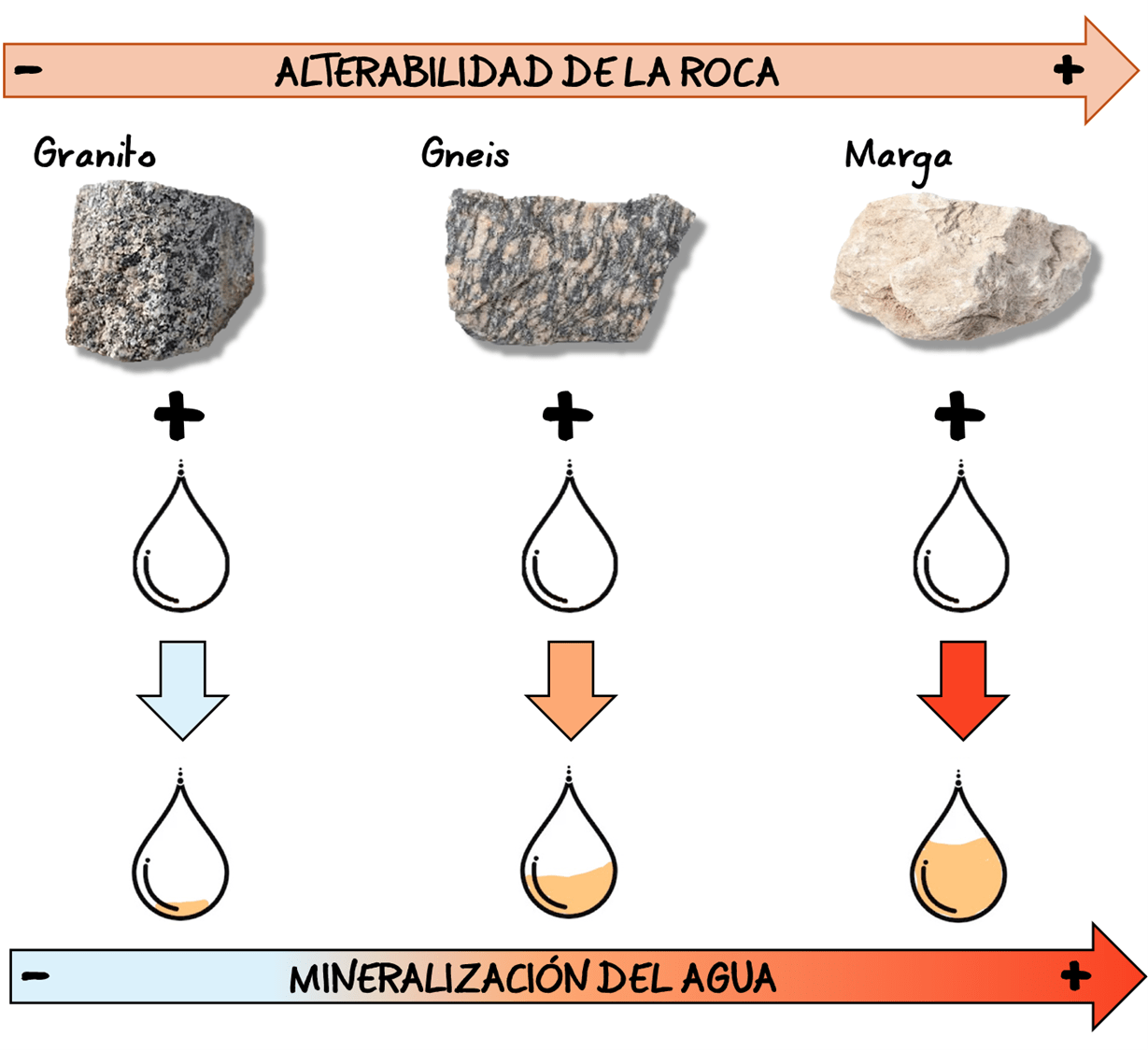
Sin embargo, esta distinción no es absoluta. Existen calizas o areniscas muy compactas que se alteran con dificultad, de forma similar a algunas rocas ígneas o metamórficas. Además, diferentes tipos de roca pueden originar composiciones hidroquímicas similares, como ocurre con calizas y mármoles, ambos ricos en carbonatos.
¿ Sabías que…
…al hablar de acuíferos, es importante señalar que las rocas que los componen pueden diferir de las rocas que se observan en la superficie. Conocer el recorrido completo del agua, desde la zona de infiltración hasta su captación, requiere estudios hidrogeológicos que integran mapas geológicos, columnas estratigráficas y análisis químicos, sobre todo si se quieren para consumo humano. Estos estudios permiten determinar el flujo de agua, junto con datos de la porosidad y la permeabilidad de las rocas (como te contamos en el post sobre los manantiales de Ulaca).
Si unimos las rocas por donde pasa el agua con las propiedades derivadas de los iones disueltos que contiene, se puede aplicar ciertas conclusiones en muchos fenómenos relacionados con la calcificación de conducciones de aguas, descalcificadores domésticos o el uso del jabón para lavadoras. El sabor del agua es otra de las características que pueden ser utilizadas para realizar experiencias didácticas como catas de agua que pueden tener un objetivo didáctico más o menos avanzado en conocimientos geológicos (Gassiot, 2002; García-Frank et al., 2017).
DISTINTAS ROCAS, DISTINTAS HUELLAS
Se han escogido cuatro marcas de agua mineral representativas de la relación con los diferentes tipos de rocas. En el Sistema Central, aguas relacionadas con rocas ígneas, en el Sistema Bético, aguas procedentes de rocas metamórficas, en el Sistema Ibérico con rocas calcáreas y en la Comarca de La Moraña con rocas sedimentarias.
En la figura 11 se muestra como las aguas relacionadas con acuíferos detríticos de la comarca de La Moraña dejan un residuo seco considerablemente superior (315 mg/L), que las aguas relacionadas con acuíferos calcáreos del Sistema Ibérico (238 mg/L) y muy superior sobre todo a las aguas procedentes de rocas cristalinas como los granitos y los esquistos del Sistema Central o la Cordillera Bética, que dan aguas más blandas (menos de 100 mg/L de residuo seco).
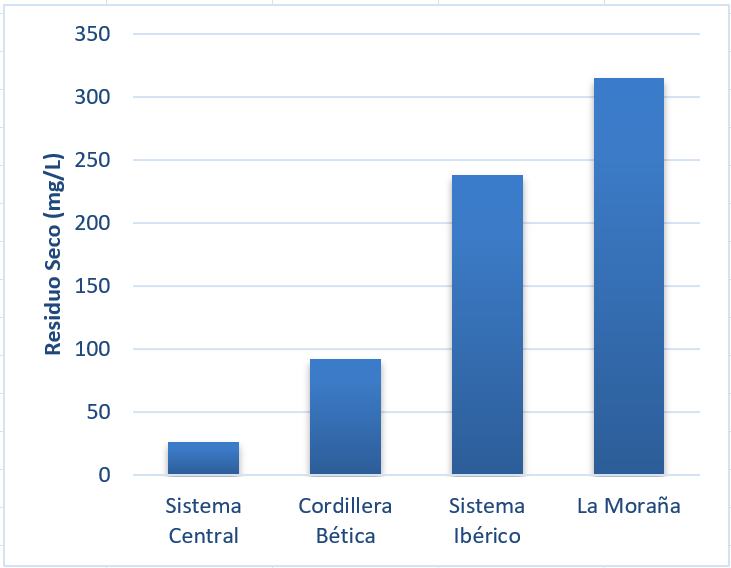
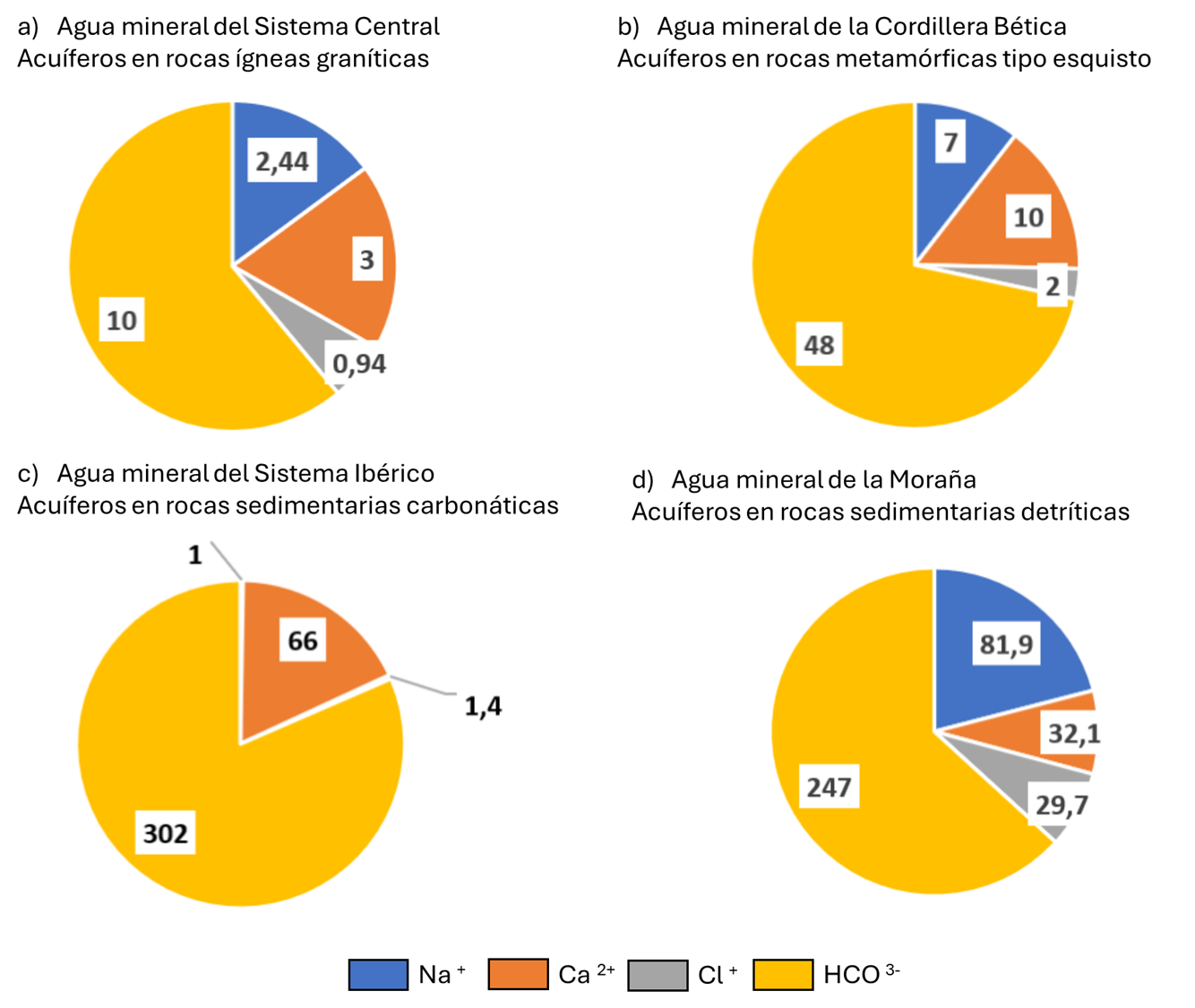
Un análisis más pormenorizado de los iones mayoritarios en estas aguas nos da más información (fig. 12). Las rocas ígneas plutónicas, como los granitos del Sistema Central, suelen dar aguas de baja mineralización, con predominio del ion bicarbonato (HCO₃⁻), sodio (Na⁺) y calcio (Ca²⁺), además de cantidades significativas de sílice disuelta. Por otra parte, las rocas metamórficas, muestran una gran variedad composicional, dando lugar a aguas con mayor mineralización aunque mayor contenido absoluto de bicarbonato que las rocas plutónicas, como ocurre con los los esquistos de la Cordillera Bética. Las aguas procedentes de acuíferos carbonatados, como los del Sistema Ibérico, ceden mayor proporción de ion bicarbonato y calcio. Por último, las rocas sedimentarias areno arcillosas al ser más porosas, son más alterables por el agua y dan mayor mineralización de sodio y cloruro, como se puede ver en el agua de la comarca de La Moraña.
La próxima vez que bebas agua mineral, puedes fijarte en la etiqueta de la botella e interpretar la huella de las rocas por donde ha circulado y donde se ha almacenado. Sabrás si se trata de agua dura o blanda, además de tener una idea de los iones que tienes en tu vaso. Verás que es mucho más que simplemente H2O.
BIBLIOGRAFÍA
Custodio, E. y Llamas, R. 1996. Hidrología Subterránea. Ed. Omega.
Gassiot, X. 2002. Análisis y cata de aguas. Enseñanza de las Ciencias de la
Tierra, 10(1): 47-51.
García-Frank, A. y Fesharaki, O (2017). Cata de aguas a ciegas: un taller inclusivo sobre aguas minerales y geología. Livro de Resumos da XXII Bienal da RSEHN, Coimbra.
WEBGRAFÍA
