Texto y gráficos – Ana Isabel Casado Gómez
Puedes escuchar el contenido de esta entrada aquí:
La técnica conocida como «Carbono 14» es un método de datación absoluta que se basa en el carbono que se encuentra en muestras de origen biológico como los fósiles o el carbón.
Los seres vivos dependemos del carbono para nuestra existencia, ya que forma parte de nuestro organismo constituyendo moléculas (ADN, colágeno, queratina…) y tejidos, tanto orgánicos como inorgánicos (plumas, pelo, huesos, conchas…). Los seres vivos obtenemos este carbono de la naturaleza mediante la ingesta de alimentos o, en el caso de las plantas, con la fotosíntesis.
Isótopos de carbono
El carbono es un elemento que se encuentra en la naturaleza como tres posibles isótopos (fig. 1):
- El Carbono-12 tiene 6 protones y 6 neutrones, 12 partículas subatómicas en su núcleo.
- El Carbono-13 tiene 6 protones y 7 neutrones, 13 partículas subatómicas en su núcleo.
- El Carbono-14 tiene 6 protones y 8 neutrones, 14 partículas subatómicas en su núcleo.
La diferencia entre un isótopo y otro es el número de neutrones que posee, ya que todos tienen los mismos protones y los mismos electrones. El nombre de los distintos isótopos de carbono viene dado por la suma de los protones y los neutrones que hay en su núcleo.

Figura 1. Los tres isótopos de carbono, tanto estables como inestables (radiactivos) con sus respectivos número de protones, neutrones y electrones; y su abundancia en la naturaleza.
El Carbono-12 y el Carbono-13 son estables y se mantendrán inalterables, mientras que el Carbono-14 es inestable (radiactivo) lo que hace que no se mantenga en el tiempo.
La abundancia natural de estos isótopos es de 98,89% de Carbono-12; 1,10% de Carbono-13 y solo 1,0×10-10 % de Carbono-14.
Para el método de datación por Radiocarbono, lo que se compara es la proporción de los isótopos Carbono-12 y Carbono-14 en la muestra.
Proporción Carbono-12 / Carbono-14 en restos biológicos
La proporción entre estos dos isótopos de carbono es la misma en una planta viva (que toma el carbono del CO2 de la atmósfera) que en un herbívoro (que toma el carbono de las plantas) y que en un carnívoro (que toma el carbono de los herbívoros que lo tomaron de las plantas). Luego, la proporción entre los distintos isótopos de carbono presente en los organismos vivos es la misma que existe en la atmósfera (fig. 2).
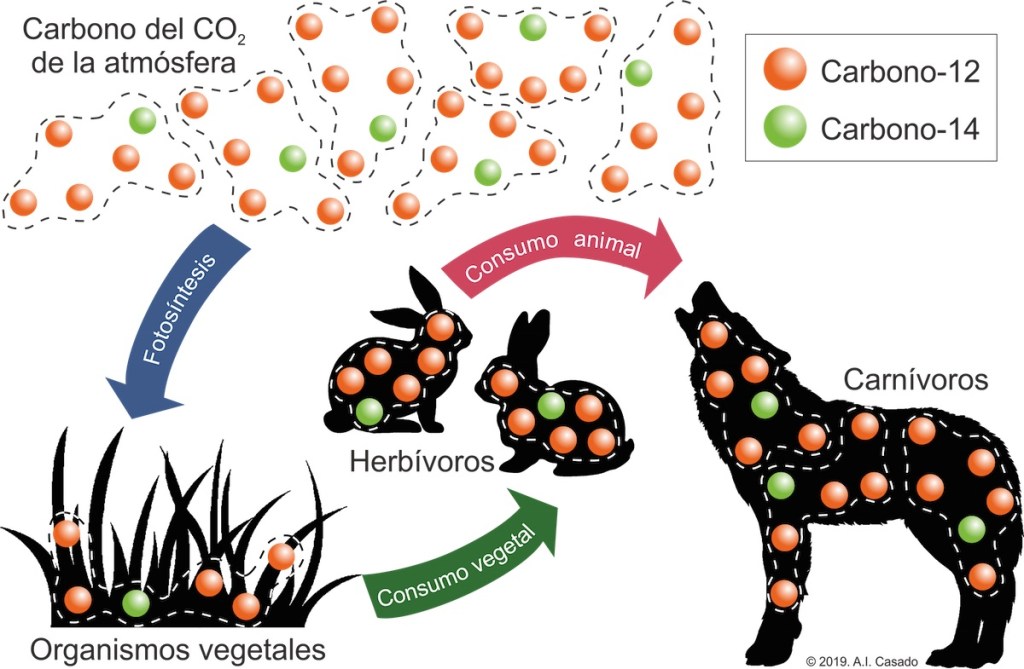
En el momento que un organismo muere, la proporción entre sus isótopos de carbono comienza a cambiar. La cantidad de Carbono-12 se mantiene igual que cuando estaba vivo pero la cantidad de Carbono-14 disminuye debido a la inestabilidad de este isótopo.
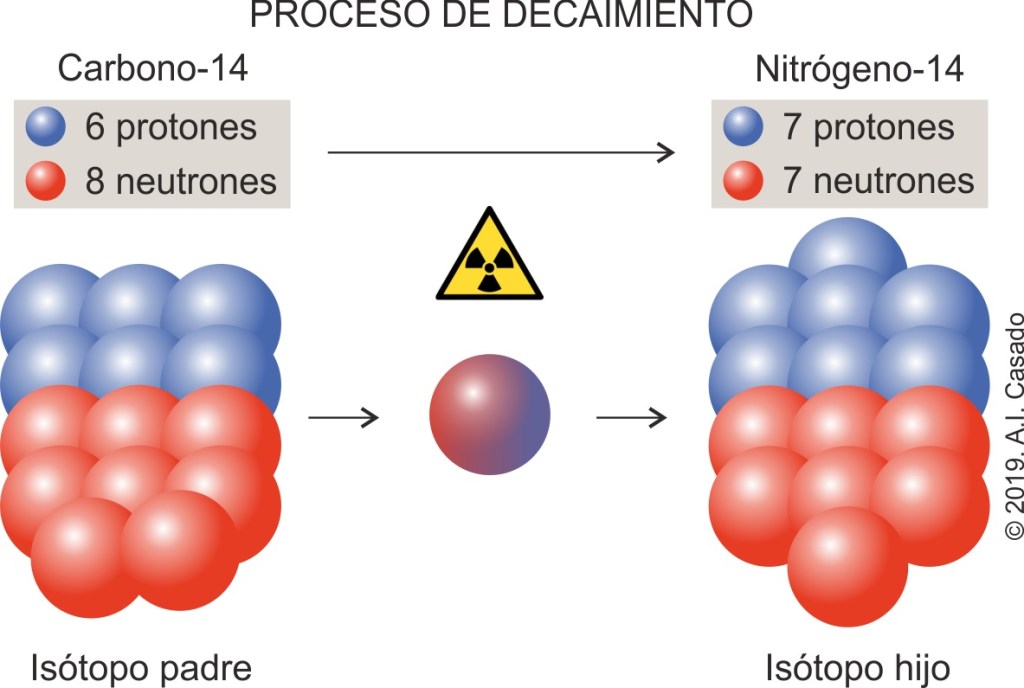
Lo que le sucede al Carbono-14 es que, al ser inestable, transforma uno de sus neutrones en un protón en lo que se conoce como proceso de decaimiento, convirtiéndose en un isótopo de Nitrógeno-14 que sí que es estable. El Carbono-14 es lo que se denomina el isótopo padre, y el Nitrógeno-14 es el isótopo hijo (fig. 3).
La cantidad de Carbono-14 de un resto orgánico se reduce de manera exponencial, formando una curva. El Carbono-14 tarda 5.730 años en reducir a la mitad su cantidad en la muestra, lo que se conoce como semivida o periodo de semidesintegración (fig. 4).
Esto significa que 5.730 años después de haber muerto el organismo, sus restos tendrá la mitad de Carbono-14 que cuando vivía; y que cuando pasen otros 5.730 años (a los 11.460 años de haber muerto) el resto tendrá la mitad de la mitad del Carbono-14 original o, lo que es lo mismo, un cuarto del Carbono-14 original.
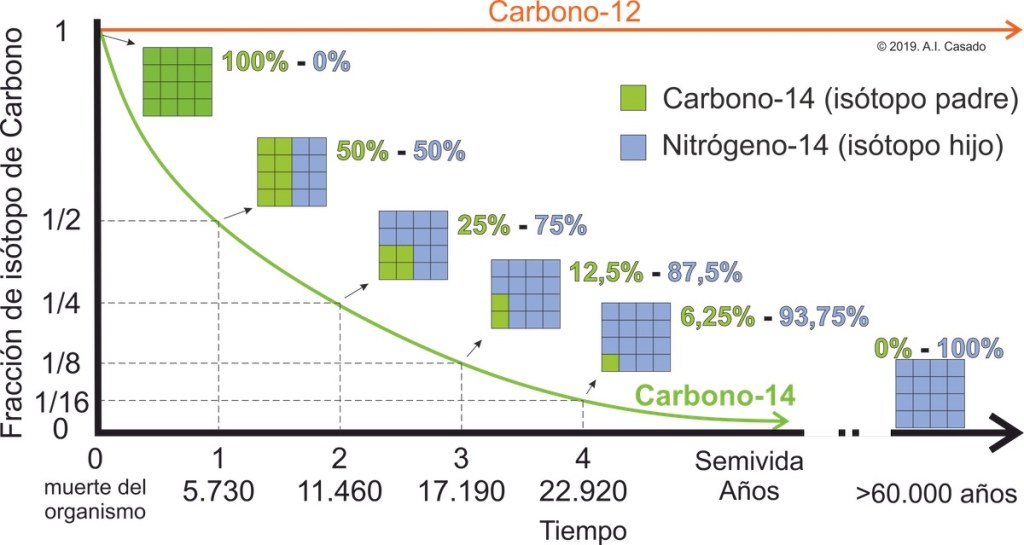
Llegará un momento en que todo el Carbono-14 original del resto biológico se haya transformado en Nitrógeno-14, el isótopo padre se agota y solo existe isótopo hijo. La datación por radiocarbono deja de ser posible. Este, por ejemplo, es el caso de los dinosaurios que vivieron hace más de 65 millones de años y cuyos fósiles no conservan isótopos de Carbono-14.
De esta manera, gracias a la proporción entre el isótopo de Carbono-12 y el de Carbono-14 en el resto biológico podemos conocer cuánto tiempo ha pasado desde que el organismo murió hasta la actualidad, siempre que no haya sido hace más de 60.000 años aproximadamente, que es la edad máxima que podemos datar por este método.

¿SABÍAS QUE…? El método de datación por Carbono-14 solo se puede emplear para restos de organismos que murieron antes de 1950 ya que, debido a la proliferación de las pruebas de armas nucleares a partir de la década de los 50 del siglo pasado, los porcentajes de isótopos radiactivos de la atmósfera se han visto gravemente alterados.
Algunos ejemplos
- En el Geolodía 2019 en El Oso vimos cómo se ha aplicado este método para datar restos vegetales encontrados dentro de los sedimentos de las dunas, lo que nos permite aproximar la edad de las propias dunas.
- En este re-descubrimiento fortuito de un trozo de madera procedente de la Gran Pirámide de Guiza se ha empleado también la datación por carbono 14. El resultado ha determinado que los restos de madera son al menos 500 años más antiguos que la propia pirámide.
¿Quieres saber más sobre métodos de datación?
